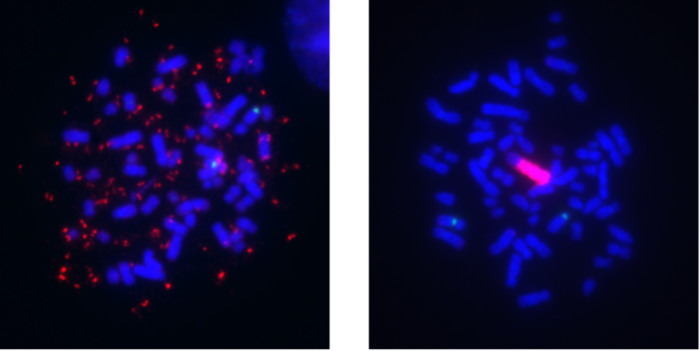
图片:黑色素瘤细胞株可以以两种显著不同的模式携带BRAF基因扩增(红色信号),即染色体外DNA (ecDNA)(左)和染色体内均匀染色区域(HSR)(右)在对MAPK抑制剂产生耐药性后。
针对黑色素瘤和其他癌症的精确治疗提高了患者的存活率,但肿瘤往往对药物停止反应,最近的研究指出,DNA(染色体内外)的变化是肿瘤发生和治疗耐药性的驱动因素。
为了研究一种关键的促癌基因通路的突变,加州大学洛杉矶分校Jonsson综合癌症中心的研究人员开发了一种黑色素瘤耐药模型,使他们能够研究导致染色体内和染色体外改变的结构和动力学,从而支持癌细胞的耐药。该模型还允许他们通过实验操作药物剂量方案和观察耐药性相关的反应,这可能会导致延长疗效的治疗方法。
“肿瘤基因组,尤其是侵袭性癌症的基因组,具有快速和不可预测的变化能力。随着基因组测序、绘图和数据分析技术的大量进展,我们开始了解染色体水平上影响肿瘤发生和耐药性的条件、结构和相互作用。在这项研究中,我们描述了BRAF和MAPK信号通路中其他基因的局部扩增机制,这是许多癌症类型的驱动因素。”Thomas Graeber博士说,他是加州大学洛杉矶分校Jonsson综合癌症中心的研究员,也是加州大学洛杉矶分校代谢组学中心的主任,他是12月20日发表在《癌症发现》杂志网络版上的一篇文章的资深作者。
BRAF突变在甲状腺癌和黑色素瘤中较为常见,已经被vemurafenib和dabrafenib等药物和其他MAPK通路抑制剂作为靶点。然而,抵抗通常是通过这一途径的重新激活,或另一种途径的激活,或两者兼而有之。在黑色素瘤中常见的MAPK通路重新激活的机制之一是BRAF扩增的获得。
染色体DNA的一个片段经过放大,被称为扩增子,可以导致癌症促进基因和那些干扰靶向治疗的基因的过度表达。然而,与正常人类细胞中的DNA不同,这种DNA可以从染色体中分离出来,因此更自由地漂浮在细胞核中。这种类型的扩增子被称为染色体外DNA (ecDNA),最初被称为双分钟(dm),因为他们是如何出现在显微镜下。
随着时间的推移,这些扩增子可以重新整合到不同的染色体中,这些整合位点被称为均匀染色区域(HSRs),因为它们包含了排成一行的长段扩增子拷贝。这两种形式的聚焦扩增都是已知的癌症发展和耐药性的贡献者,而DM和HSR模式之间的切换是癌细胞如何进化或显示“可塑性”的一个例子。“尽管早在60多年前就发现了它们,但直到最近几年,技术进步才开始全面揭示它们的结构、组织和在肿瘤进化中的作用。”
该研究的第一作者、格雷伯实验室的研究生Kai Song说:“这项研究旨在提供与黑色素瘤耐药性相关的mapk相关局部扩增的结构、动力学和脆弱性的详细信息。”“对这些结构和相互作用的完整认识是我们理解肿瘤进化和可塑性以及开发克服耐药性的治疗方法的核心。”
研究人员用针对MAPK信号通路的激酶抑制剂治疗人类黑色素瘤细胞株,以建立耐药性模型。最初,高BRAF基因扩增是在染色体外的DNA形式,但在一个稳定的药物剂量下,经过几个月的培养,机制切换到染色体内的HSR形式。根据作者的说法,对黑素瘤模式切换的观察增加了文献中关于不同癌症类型的局灶性扩增癌基因类似事件的相关报道,包括白血病和神经母细胞瘤。
研究发现,每种形式的DNA都为肿瘤细胞提供了不同的“适应”优势,比如对不断变化的治疗条件作出反应。例如,当细胞暴露于持续、稳定的药物剂量治疗时,染色体内的HSRs似乎比染色体外的HSRs“更适合”促进癌症生长——这支持了在这些条件下从dm到HSRs的适应驱动进化。然而,一个非稳定或振荡的药物剂量挑战创造了一个优势,即没有扩增子拷贝数绑定到染色体上,因此携带dm的细胞被保留。
尽管传统上认为dm细胞比HSR细胞更具可塑性,但研究发现HSR细胞也具有扩增子拷贝数量的可塑性。当药物剂量减少时,高铁的长度可以缩短,使癌细胞摆脱产生耐药性时出现的“药物成瘾”。与加州大学圣地亚哥分校计算机科学系的一个团队合作,在Vineet Bafna博士的指导下,通过DNA结构分析揭示了HSR缩短的机制,即扩增子的去除,而HSR没有进一步改变。
这一发现得到了由UCLA Jonsson综合癌症中心成员Roger Lo博士领导的研究小组的文献和临床研究报告的支持。他们发现在患者肿瘤和患者来源的异种移植模型肿瘤中,MAPK基因的局部扩增具有可塑性的证据,这些肿瘤已经对MAPK抑制剂治疗产生了耐药性。
在其他重要的结果中,研究小组记录了尽管黑素瘤细胞可能对信号通路抑制药物产生耐药性,但药物治疗似乎使它们容易受到另一种治疗形式的伤害。通过MAPK抑制,黑色素瘤细胞将其主要的能量生成程序从糖酵解或葡萄糖代谢转移到细胞内的呼吸和能量生成的线粒体途径。这导致处理过的细胞中活性氧化应激的产生升高。这种级联在之前的研究中已经观察到,加州大学洛杉矶分校领导的研究小组在聚焦放大背景下扩展了研究结果,以确定细胞中脂肪分子氧化的参与。这一发现揭示了氧化应激细胞易受一类新药物的伤害,即所谓的原铁卟啉药物,这种药物可触发氧化脂质介导的细胞程序性死亡。
“这个模型系统的一个重要价值是,它允许我们使用这些基于耐药性的聚焦放大方法来寻找癌细胞的新弱点。我们的最终目标是治疗这些弱点。”格雷伯说。
文章标题
Plasticity of extrachromosomal and intrachromosomal BRAF amplifications in overcoming targeted therapy dosage challenges